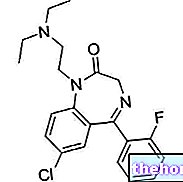
Untuk membincangkan mengenai dua puluh asid amino yang membentuk struktur protein dan yang diubahsuai, perlu menerangkan sekurang-kurangnya dua belas jalur metabolik khusus.
Tetapi mengapa sel menggunakan begitu banyak jalur metabolik yang memerlukan tenaga (misalnya untuk menjana semula tapak pemangkin enzim), masing-masing dengan patrimoni enzimatik, untuk memetabolisme asid amino? Dari hampir semua asid amino adalah mungkin untuk memperoleh, melalui jalur khusus, metabolit yang sebahagiannya digunakan untuk menghasilkan tenaga (contohnya, melalui glukoneogenesis dan jalur badan keton) tetapi yang, terutama sekali, membawa kepada pembentukan kompleks molekul, dengan bilangan atom karbon yang tinggi (contohnya dari fenilalanin dan tirosin, hormon dihasilkan di kelenjar adrenal yang khusus untuk tujuan ini); jika di satu pihak adalah mudah untuk menghasilkan tenaga dari asid amino, di sisi lain adalah sukar untuk membina molekul kompleks bermula dari molekul kecil: katabolisme asid amino memungkinkan mereka mengeksploitasi kerangka mereka untuk mendapatkan spesies yang lebih besar.
Dua atau tiga hektogram asid amino dikurangkan setiap hari oleh individu yang sihat: 60-100 g daripadanya berasal dari protein yang diperkenalkan dengan diet tetapi lebih dari 2 hektogram diperoleh dari pergantian normal protein yang merupakan bahagian yang tidak terpisahkan dari organisma ( asid amino protein ini, yang rosak oleh proses redoks, digantikan oleh yang lain dan dikatabolisme).
Asid amino memberikan sumbangan tenaga dari segi ATP: setelah mengeluarkan kumpulan α-amino, rangka karbonat yang tersisa dari asid amino, setelah transformasi yang sesuai, dapat memasuki kitaran krebs. Selanjutnya, apabila bekalan nutrien kurang dan kuantiti glukosa berkurang, glukoneogenesis diaktifkan: asid amino glukoneogenetik dikatakan sebagai yang, setelah pengubahsuaian yang sesuai, dapat dimasukkan ke dalam glukoneogenesis; asam amino glukoneogenetik adalah yang dapat diubah menjadi piruvat atau dalam fumarate (fumarate dapat diubah menjadi malate yang meninggalkan mitokondria dan, dalam sitoplasma, diubah menjadi oksaloasetat dari mana fosfenol piruvat dapat diperoleh). cuka-asetat.
Yang dijelaskan adalah aspek yang sangat penting kerana asid amino dapat mengatasi kekurangan gula sekiranya berpuasa segera; jika puasa berterusan, setelah dua hari metabolisme lipid campur tangan (kerana struktur protein tidak dapat diserang terlalu banyak), pada tahap ini, kerana glukoneogenesis sangat terhad, asid lemak diubah menjadi asetil koenzim A dan badan keton. Dari puasa lebih lanjut, otak juga menyesuaikan diri dengan menggunakan badan keton.
Pemindahan kumpulan α-amino dari asid amino berlaku melalui tindak balas transaminasi; enzim yang menjadi pemangkin reaksi ini, mereka mengatakan, sebenarnya, transaminase (atau transferase amino). Enzim ini menggunakan kofaktor enzimatik yang disebut pyridoxal fosfat, yang mengganggu kumpulan aldehidnya. Pyridoxal fosfat adalah produk dari fosforilasi pyridoxine yang merupakan vitamin (B6) yang terdapat terutamanya pada sayur-sayuran.
Transaminase mempunyai sifat berikut:
Kekhususan tinggi untuk pasangan α ketoglutarate-glutamat;
Mereka diberi nama pasangan kedua.
Enzim transaminase selalu melibatkan pasangan α ketoglutarate-glutamat dan dibezakan mengikut pasangan kedua yang terlibat.
Contoh:
L "transaminase aspartat iaitu GOT (Glutamate-Ossal asetat Transaminase): enzim memindahkan kumpulan α-amino dari aspartat ke α-ketoglutarate, memperoleh oksaloasetat dan glutamat.
L "transaminase alanin iaitu GTP (Glutamate-Pyruvate Transaminase): enzim memindahkan kumpulan α-amino dari "alanine ke" α-ketoglutarate, memperoleh piruvat dan glutamat.
Pelbagai transaminase menggunakan α-ketoglurate sebagai akseptor kumpulan amino asid amino dan mengubahnya menjadi glutamat; sementara, asid amino yang terbentuk digunakan di jalur badan keton.
Jenis tindak balas ini boleh berlaku di kedua arah kerana ia memutuskan dan membentuk ikatan dengan kandungan tenaga yang sama.
Transaminase berada di sitoplasma dan di mitokondria (kebanyakannya aktif di sitoplasma) dan berbeza dari sudut isoelektriknya.
Transaminase juga mampu menguraikan asid amino.
Pasti ada cara untuk menukar glutamat kembali menjadi α-ketoglutarate: ini dilakukan dengan penyahbauan.
Di sana glutamat dehidrogenase ia adalah enzim yang mampu mengubah glutamat menjadi α-ketoglutarate dan, oleh itu, mengubah kumpulan amino asid amino yang terdapat dalam bentuk glutamat menjadi ammonia. Apa yang berlaku adalah proses redoks yang melalui α-amino glutarate menengah: ammonia dan α-ketoglutarate dilepaskan dan kembali ke peredaran.
Kemudian, pembuangan kumpulan amino asid amino melalui transaminase (yang berbeza mengikut substrat) dan glutamat dehidrogenase, yang menentukan pembentukan ammonia.
Terdapat dua jenis glutamat dehidrogenase: sitoplasma dan mitokondria; kofaktor, yang juga merupakan kosubstrat enzim ini adalah NAD (P) +: glutamat dehidrogenase menggunakan NAD + atau NADP + sebagai akseptor penurunan kuasa. Bentuk sitoplasma lebih suka, walaupun tidak secara eksklusif, NADP + sementara bentuk mitokondria lebih memilih NAD +. Bentuk mitokondria mempunyai tujuan untuk membuang kumpulan amino: ia membawa kepada pembentukan ammonia (yang merupakan substrat untuk enzim khusus dalam mitokondria) dan NADH (yang dikirim ke rantai pernafasan). Bentuk sitoplasma berfungsi dalam arah yang bertentangan, ia menggunakan ammonia dan α-ketoglutarate untuk memberikan glutamat (yang mempunyai tujuan biosintetik): reaksi ini adalah biosintesis reduktif dan kofaktor yang digunakan adalah NADPH.
Glutamat dehidrogenase berfungsi apabila perlu untuk membuang kumpulan amino asid amino seperti amonia (melalui air kencing) atau ketika rangka asid amino diperlukan untuk menghasilkan tenaga: oleh itu enzim ini akan mempunyai modulator negatif sistem yang menjadi petunjuk ketersediaan tenaga yang baik (ATP, GTP dan NAD (P) H) dan sebagai modulator positif, sistem yang menunjukkan keperluan tenaga (AMP, ADP, PDB, NAD (P) +, asid amino dan hormon tiroid).
Asid amino (terutamanya leucine) adalah modulator positif dehidrogenase glutamat: jika asid amino terdapat di sitoplasma, ia boleh digunakan untuk sintesis protein, atau mereka mesti dibuang kerana tidak dapat terkumpul (ini menjelaskan mengapa asid amino adalah modulator positif ).
Pembuangan ammonia: kitaran urea
Ikan membuang amonia dengan memasukkannya ke dalam air melalui insang; burung mengubahnya menjadi asid urik (yang merupakan produk pemeluwapan) dan menghilangkannya dengan najis. Mari kita lihat apa yang berlaku pada manusia: kita telah mengatakan bahawa glutamat dehidrogenase mengubah glutamat dalam α- ketoglutarate dan amonia tetapi kita belum mengatakan bahawa ini berlaku hanya pada mitokondria hati.
Peranan asas pembuangan amonia, melalui kitaran urea, dimainkan oleh transaminase mitokondria.

Karbon dioksida, dalam bentuk ion bikarbonat (HCO3-), diaktifkan oleh kofaktor biotin yang membentuk biotin karboksik yang bertindak balas dengan ammonia untuk memberikan asid karbamat; tindak balas seterusnya menggunakan ATP untuk memindahkan fosfat ke asid karbamat membentuk karbamil fosfat dan ADP (penukaran ATP menjadi ADP adalah pendorong untuk memperoleh karboksibiotin). Fasa ini dikatalisis oleh sintetase karbamil fosfat dan berlaku di mitokondria. Carbamyl phosphate dan ornithine adalah substrat untuk enzim trans karbamilase ornithine yang mengubahnya menjadi citrulline; tindak balas ini berlaku di mitokondria (hepatosit). Citrulline yang dihasilkan meninggalkan mitokondria dan, dalam sitoplasma, berada di bawah "tindakan"arginine succinate synthetase: terdapat perpaduan antara kerangka karbonat citrulline dan aspartat melalui serangan nukleofilik dan penghapusan air berikutnya. Enzim sintetikase arginin suksinat memerlukan molekul ATP sehingga ada gandingan energetik: hidrolisis ATP ke AMP dan pirofosfat (yang terakhir kemudian diubah menjadi dua molekul ortofosfat) berlaku oleh pengusiran molekul d "air dari substrat dan bukan dengan tindakan air medium.
"Enzim seterusnya adalah"arginine succinase: enzim ini mampu membahagikan arginine succinate menjadi arginine dan fumarate di dalam sitoplasma.
Kitaran urea diselesaikan oleh enzim arginase: urea dan ornithine diperoleh; urea dibuang oleh ginjal (air kencing) sementara ornithine kembali ke mitokondria dan meneruskan kitaran.
Kitaran urea dikenakan modulasi tidak langsung oleh arginine: pengumpulan arginin menunjukkan bahawa kitaran urea mesti dipercepat; modulasi arginin tidak langsung kerana arginin secara positif memodulasi enzim sintetase asetil glutamat. Yang terakhir ini dapat memindahkan kumpulan asetil pada nitrogen glutamat: N-asetil glutamat terbentuk yang merupakan modulator langsung enzim karbamil-fosfon sintetase.
Arginin berkumpul sebagai metabolit kitaran urea jika pengeluaran karbamil fosfat tidak mencukupi untuk membuang ornithine.
Urea dihasilkan hanya di hati tetapi ada laman web lain di mana reaksi awal berlaku.
Otak dan otot menggunakan strategi khas untuk menghilangkan kumpulan amino. Otak menggunakan kaedah yang sangat berkesan di mana enzim digunakan sintetase glutamin dan enzim glutamase: yang pertama terdapat pada neuron, sementara yang kedua terdapat di hati. Mekanisme ini sangat berkesan kerana dua sebab:
Dua kumpulan amino diangkut dari otak ke hati dalam satu kenderaan;
Glutamin kurang toksik daripada glutamat (glutamat juga melakukan pemindahan neuron dan tidak boleh melebihi kepekatan fisiologi).
Pada ikan, mekanisme serupa membawa kumpulan amino asid amino ke insang.
Dari otot (rangka dan jantung), kumpulan amino mencapai hati melalui kitaran glukosa-alanin; enzim yang terlibat adalah transaminase glutamin-piruvat: ia membolehkan peralihan kumpulan amino (yang dalam bentuk glutamat), menukar piruvat menjadi alanin dan, pada masa yang sama, glutamat menjadi α-ketoglutarat dalam otot dan, memangkinkan proses terbalik di hati.
Transaminase dengan tugas atau kedudukan yang berbeza juga mempunyai perbezaan struktur dan dapat ditentukan oleh elektroforesis (mereka mempunyai titik isoelektrik yang berbeza).
Kehadiran transaminase dalam darah boleh menjadi gejala kerosakan hati atau jantung (iaitu kerosakan tisu pada sel hati atau jantung); transaminase berada dalam kepekatan yang sangat tinggi di hati dan di jantung: melalui elektroforesis adalah mungkin untuk menentukan sama ada kerosakan telah berlaku di sel hati atau jantung.